ВОДА, ЛЕД И ПАР
ВОДА, ЛЕД И ПАР, соответственно жидкое, твердое и газообразное состояния химического соединения молекулярной формулы Н2О.
Историческая справка.
Идея древних философов о том, что все в природе образуют четыре элемента (стихии): земля, воздух, огонь и вода, просуществовала вплоть до Средних веков. В 1781 Г.Кавендиш сообщил о получении им воды при сжигании водорода, но не оценил в полной мере важности своего открытия. Позже (1783) А.Лавуазье доказал, что вода вовсе не элемент, а соединение водорода и кислорода. Й.Берцелиус и П.Дюлонг (1819), а также Ж.Дюма и Ж.Стас (1842) установили весовой состав воды, пропуская водород через оксид меди, взятый в строго определенном количестве, и взвешивая образовавшиеся медь и воду. Исходя из этих данных, они определили отношение Н:О для воды. Кроме того, в 1820-х годах Ж.Гей-Люссак измерил объемы газообразных водорода и кислорода, которые при взаимодействии давали воду: они соотносились между собой как 2:1, что, как мы теперь знаем, отвечает формуле Н2О.
Распространенность.
Вода покрывает 3/4 поверхности Земли. Тело человека состоит из воды примерно на 70%, яйцо – на 74%, а некоторые овощи – это почти одна вода. Так, в арбузе ее 92%, в спелых томатах – 95%.
Вода в природных резервуарах никогда не бывает однородной по составу: она проходит через горные породы, соприкасается с почвой и воздухом, а потому содержит растворенные газы и минеральные вещества. Более чистой является дистиллированная вода.
Морская вода.
Состав морской воды различается в разных регионах и зависит от притока пресных вод, скорости испарения, количества осадков, таяния айсбергов и т.д. См. также ОКЕАН.
Минеральная вода.
Минеральная вода образуется при просачивании обычной воды сквозь породы, содержащие соединения железа, лития, серы и других элементов.
Мягкая и жесткая вода.
Жесткая вода содержит в больших количествах соли кальция и магния. Они растворяются в воде при протекании по породам, сложенным гипсом (СaSO4), известняком (СаСО3) или доломитом (карбонаты Mg и Са). В мягкой воде этих солей мало. Если вода содержит сульфат кальция, то говорят, что она обладает постоянной (некарбонатной) жесткостью. Ее можно умягчить добавлением карбоната натрия; это приведет к осаждению кальция в виде карбоната, а в растворе останется сульфат натрия. Соли натрия не вступают в реакцию с мылом, и расход его будет меньше, чем в присутствии солей кальция и магния.
Вода, обладающая временной (карбонатной) жесткостью, содержит бикарбонаты кальция и магния; ее можно умягчить несколькими способами: 1) нагреванием, приводящим к разложению бикарбонатов на нерастворимые карбонаты; 2) добавлением известковой воды (гидроксида кальция), в результате чего бикарбонаты превращаются в нерастворимые карбонаты; 3) с помощью обменных реакций.
Вода, содержащая в большом количестве растворенный диоксид углерода, просачиваясь через известняковые породы, растворяет их, что приводит к образованию пещер. При повышении температуры начинается обратный процесс: бикарбонат разлагается и вновь образуется известняк. Именно из него состоят сталактиты и сталагмиты.
Молекулярная структура.
Анализ данных, полученных из спектров поглощения, показал, что три атома в молекуле воды образуют равнобедренный треугольник с двумя атомами водорода в основании и кислородом в вершине:
Валентный угол НОН равен 104,31°, длина связи О–Н составляет 0,99 Å (1 Å = 10–8 см), а расстояние Н–Н равно 1,515 Å. Атомы водорода так глубоко «внедрены» в атом кислорода, что молекула оказывается почти сферической; ее радиус – 1,38 Å.
ВОДА
Физические свойства.
Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0° С) и кипения (100° С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Чистая вода – плохой проводник электричества, ее удельная электропроводность равна 1,5Ч10–8 Ом–1Чсм–1 при 0° С. Сжимаемость воды очень мала: 43Ч10–6 см3 на мегабар при 20° С. Плотность воды максимальна при 4° С; это объясняется свойствами водородных связей ее молекул.
Давление паров.
Если оставить воду в открытой емкости, то она постепенно испарится – все ее молекулы перейдут в воздух. В то же время вода, находящаяся в плотно закупоренном сосуде, испаряется лишь частично, т.е. при определенном давлении водяных паров между водой и воздухом, находящимся над ней, устанавливается равновесие. Давление паров в равновесии зависит от температуры и называется давлением насыщенного пара (или его упругостью). Когда давление насыщенного пара сравнивается с внешним давлением, вода закипает. При обычном давлении 760 мм рт.ст. вода кипит при 100° С, а на высоте 2900 м над уровнем моря атмосферное давление падает до 525 мм рт.ст. и температура кипения оказывается равной 90° С.
Испарение происходит даже с поверхности снега и льда, именно поэтому высыхает на морозе мокрое белье.
Вязкость воды с ростом температуры быстро уменьшается и при 100° С оказывается в 8 раз меньше, чем при 0° С.
Химические свойства.
Каталитическое действие.
Очень многие химические реакции протекают только в присутствии воды. Так, окисление кислородом не происходит в сухих газах, металлы не реагируют с хлором и т.д.
Гидраты.
Многие соединения всегда содержат определенное число молекул воды и называются поэтому гидратами. Природа образующихся при этом связей может быть разной. Например, в пентагидрате сульфата меди, или медном купоросе CuSO4Ч5H2O, четыре молекулы воды образуют координационные связи с ионом сульфата, разрушающиеся при 125° С; пятая же молекула воды связана так прочно, что отрывается лишь при температуре 250° С. Еще один стабильный гидрат – серная кислота; она существует в двух гидратных формах, SO3ЧH2O и SO2(OH)2, между которыми устанавливается равновесие. Ионы в водных растворах тоже часто бывают гидратированы. Так, Н+ всегда находится в виде иона гидроксония Н3О+ или Н5О2+; ион лития – в виде Li (H2O)6+ и т.д. Элементы как таковые редко находятся в гидратированной форме. Исключение составляют бром и хлор, которые образуют гидраты Br2Ч10 H2O и Cl2Ч6H2О. Некоторые обычные гидраты содержат кристаллизационную воду, например хлорид бария BaCl2Ч2H2O, английская соль (сульфат магния) MgSO4Ч7H2O, питьевая сода (карбонат натрия) Na2CO3Ч10 H2O, глауберова соль (сульфат натрия) Na2SO4Ч10 H2O. Соли могут образовывать несколько гидратов; так, сульфат меди существует в виде CuSO4Ч5H2O, CuSO4Ч3H2O и CuSO4ЧH2O. Если давление насыщенного пара гидрата больше, чем атмосферное давление, то соль будет терять воду. Этот процесс называется выцветанием (выветриванием). Процесс, при котором соль поглощает воду, называется расплыванием.
Гидролиз.
Гидролиз – это реакция двойного разложения, в которой одним из реагентов является вода; трихлорид фосфора PCl3 легко вступает в реакцию с водой:
PCl3 + 3H2O = P (OH)3 + 3HCl
Аналогичным образом гидролизуются жиры с образованием жирных кислот и глицерина.
Сольватация.
Вода – полярное соединение, а потому охотно вступает в электростатическое взаимодействие с частицами (ионами или молекулами) растворенных в ней веществ. Образовавшиеся в результате сольватации молекулярные группы называются сольватами. Слой молекул воды, связанный с центральной частицей сольвата силами притяжения, составляет сольватную оболочку. Впервые понятие сольватации было введено в 1891 И.А.Каблуковым.
Тяжелая вода.
В 1931 Г.Юри показал, что при испарении жидкого водорода его последние фракции оказываются тяжелее обычного водорода вследствие содержания в них в два раза более тяжелого изотопа. Этот изотоп называется дейтерием и обозначается символом D. По своим свойствам вода, содержащая вместо обычного водорода его тяжелый изотоп, существенно отличается от обычной воды.
В природе на каждые 5000 массовых частей Н2О приходится одна часть D2O. Это соотношение одинаково для речной, дождевой, болотной воды, подземных вод или кристаллизационной воды. Тяжелая вода используется в качестве метки при исследовании физиологических процессов. Так, в моче человека соотношение между Н и D тоже равно 5000:1. Если дать пациенту выпить воду с большим содержанием D2O, то, последовательно измеряя долю этой воды в моче, можно определить скорость выведения воды из организма. Оказалось, что около половины выпитой воды остается в организме даже спустя 15 сут. Тяжелая вода, вернее, входящий в ее состав дейтерий – важный участник реакций ядерного синтеза.
Третий изотоп водорода – тритий, обозначаемый символом Т. В отличие от первых двух он радиоактивен и обнаружен в природе лишь в малых количествах. В пресноводных озерах соотношение между ним и обычным водородом равно 1:1018, в поверхностных водах – 1:1019, в глубинных водах он отсутствует. См. также ВОДОРОД.
ЛЕД
Лед, твердая фаза воды, используется в основном как хладагент. Он может находиться в равновесии с жидкой и газообразной фазами или только с газообразной фазой. Толстый слой льда имеет голубоватый цвет, что связано с особенностями преломления им света. Сжимаемость льда очень низка.
Лед при нормальном давлении существует только при температуре 0° С или ниже и обладает меньшей плотностью, чем холодная вода. Именно поэтому айсберги плавают в воде. При этом, поскольку отношение плотностей льда и воды при 0° С постоянно, лед всегда выступает из воды на определенную часть, а именно на 1/5 своего объема. См. также АЙСБЕРГИ.
ПАР
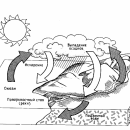
Пар – газообразная фаза воды. Вопреки общепринятому мнению, он невидим. Тот «пар», который вырывается из кипящего чайника, – это на самом деле множество мельчайших капелек воды. Пар обладает свойствами, очень важными для поддержания жизни на Земле. Хорошо известно, например, что под действием солнечного тепла вода с поверхности морей и океанов испаряется. Образующиеся водяные пары поднимаются в атмосферу и конденсируются, а затем выпадают на землю в виде дождя и снега. Без такого круговорота воды наша планета давно превратилась бы в пустыню.
Пар имеет множество применений. С одними мы хорошо знакомы, о других только слышали. Среди наиболее известных устройств и механизмов, работающих с применением пара, – утюги, паровозы, пароходы, паровые котлы. Пар вращает турбины генераторов на тепловых электростанциях. См. также КОТЕЛ ПАРОВОЙ; ДВИГАТЕЛЬ ТЕПЛОВОЙ; ТЕПЛОТА; ТЕРМОДИНАМИКА.
Эйзенберг Д., Кауцман В. Структура и свойства воды. Л., 1975
Зацепина Г.Н. Физические свойства и структура воды. М., 1987
Ответь на вопросы викторины «Физика»