ФЕРРОЦЕН
ФЕРРОЦЕН – бис-циклопентадиенилжелезо, устойчивое железоорганическое соединение (то есть, содержащих связь Fe–C), кристаллическое вещество оранжевого цвета,
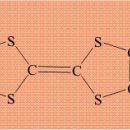
Тпл. 173° С. Ферроцен впервые был получен в 1951 Т.Кили и П.Посоном, которые по результатам анализа предложили для него структуру, которая напрашивалась сама собой – два углеводородных цикла, соединенных атомом железа:
ФЕРРОЦЕН – бис-циклопентадиенилжелезо, устойчивое железоорганическое соединение (то есть, содержащих связь Fe–C), кристаллическое вещество оранжевого цвета,
Тпл. 173° С. Ферроцен впервые был получен в 1951 Т.Кили и П.Посоном, которые по результатам анализа предложили для него структуру, которая напрашивалась сама собой – два углеводородных цикла, соединенных атомом железа:
ФЕРРОЦЕН – бис-циклопентадиенилжелезо, устойчивое железоорганическое соединение (то есть, содержащих связь Fe–C), кристаллическое вещество оранжевого цвета,
Тпл. 173° С. Ферроцен впервые был получен в 1951 Т.Кили и П.Посоном, которые по результатам анализа предложили для него структуру, которая напрашивалась сама собой – два углеводородных цикла, соединенных атомом железа:
Исследуя свойства этого соединения, Р.Вудворд установил в 1952 его истинное строение, которое оказалось необычным. Молекула имеет форму сандвича, атом железа находится между двумя параллельными плоскостями органических циклов.
В ферроцене простые и двойные связи циклов С5Н5 усреднены, как в бензоле, что обозначают кольцевым символом внутри цикла. Особенность строения ферроцена состоит в том, что атом металла взаимодействует не с одним конкретным атомом углерода, а сразу со всеми атомами углерода двух органических молекул. Орбитали р-электронов, принадлежащих циклам, перекрываются друг с другом и с незанятыми d-орбиталями металла (орбиталь – пространственная область возможного обитания электрона или, проще, электронное облако определенной формы, р-орбитали имеют форму объемных восьмерок). Возникает комплексное соединение, где в образовании связи с атомом железа принимают участие все р-электроны циклопентадиенильных колец, образуя с металлом координационные связи. Это самостоятельный тип химической связи, получивший название p-комплексной связи.
Получают ферроцен двухстадийным синтезом. Вначале проводят взаимодействие циклопентадиена с металлическим натрием, при этом фактически происходит замещение водорода на натрий, как при реакции металла с кислотой. В результате получают циклопентадиенил натрия, ионное соединение (подобное NaCl):
Полученное соединение, реагируя с галогенидом Fe(II), образует ферроцен:
Благодаря p-комплексным связям в ферроцене возникает единая электронная система, соединение приобретает ароматические свойства (см. АРОМАТИЧНОСТЬ), по химическим свойствам оно напоминает бензол: атомы водорода могут легко замещаться на различные органические группы, например, на ацетильные:
Реакции присоединения, как и для бензола, не характерны. Ферроцен стал первым представителем небензоидных ароматических систем.
Ферроцен устойчив до 470° С, не разлагается кислотами и щелочами, растворим в большинстве органических растворителей.
Открытие ферроцена существенно расширило существующие представления о природе химических связей и знаменовало появление новой главы в химической науке – химии p-комплексов переходных металлов.
Михаил Левицкий
Перевалова Э.Г., Решетова М.Д., Грандберг К.И. Методы элементоорганической химии. Железоорганические соединения. Ферроцен. «Наука», М., 1983
Ответь на вопросы викторины «Неизвестные подробности»