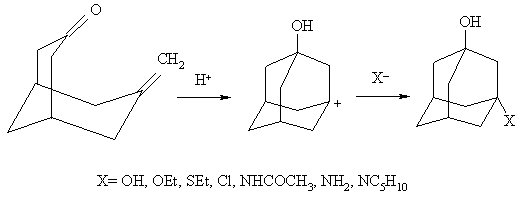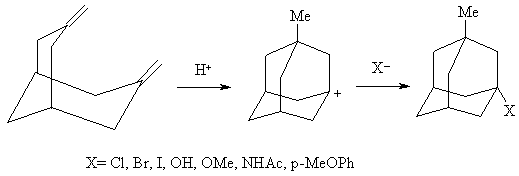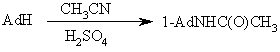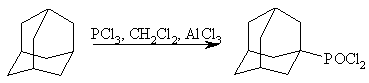АДАМАНТАН
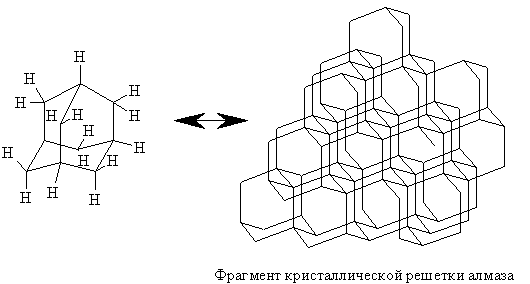
АДАМАНТАН – трицикличесий мостиковый углеводород состава С10H16, молекула которого состоит из трех циклогексановых колец; пространственное расположение атомов углерода в молекуле адамантана то же, что и в кристаллической решетке алмаза. Согласно систематической номенклатуре, адамантан следует называть – трицикло [3.3.1.13,7] деканом.
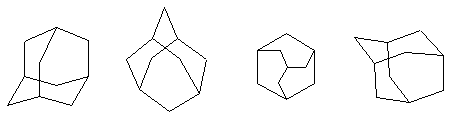
Обычно адамантан изображают одним из следующих способов:
В органической химии существует небольшое число веществ, которые вызывали громадный интерес химиков всего мира. Среди подобных соединений – структуры бензола, ферроцена, карборана, фуллеренов и адамантана, есть и другие молекулярные структуры, вызывавшие и вызывающие интерес химиков-органиков. Вероятно, это во многом обусловлено необычностью структуры самих молекул, особенно высокой степенью их симметрии.
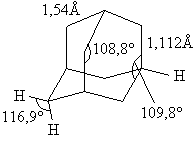
Строение адамантана.
Углеродный скелет молекулы адамантана подобен структурной единице алмаза.
Именно поэтому название «адамантан» произошло от греческого «adamas» – алмаз. Экспериментально полученные структурные характеристики адамантана:
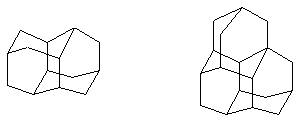
Подобная структура сохраняется практически у всех производных адамантана, что обусловлено высокой устойчивостью адамантанового каркаса. Адамантан – родоначальник гомологического ряда семейства углеводородов алмазоподобного строения диамантана, триамантана и т.д.:
На основе химии адамантана возникла и развилась одна из областей современной органической химии – химия органических полиэдранов.
Адамантан, несмотря на небольшую молекулярную массу, обладает необычно высокой для насыщенных углеводородов температурой плавления – 269° С. Эта аномально высокая температура обусловлена высокой симметрией жесткой алмазоподобной молекулы адамантана. Вместе с тем, относительно слабое межмолекулярное взаимодействие в кристаллической решетке приводит к тому, что углеводород легко возгоняется, частично – уже при комнатной температуре.
В отличие от самого адамантана, его алкилзамещенные плавятся при гораздо более низких температурах (1-метиладамантан – при 103° С, а 1-этиладамантан – при –58° С) вследствие нарушения симметрии молекулы и увеличения колебательной и вращательной подвижности ее звеньев.
Несмотря на отсутствие в адамантане асимметрического атома углерода (атома углерода, связанного с четырьмя различными заместителями, расположенными в вершинах тетраэдра), производные адамантана, содержащие четыре различных заместителя в узловых положениях, оптически активны. Центр молекулы таких производных адамантана выполняет роль гипотетического асимметрического атома углерода.
Например:
В данном случае оптическая активность обусловлена возникновением особого типа асимметрии – асимметрии молекулярного тетраэдра. Величина оптического вращения для таких соединений невелика и редко превышает 1°.
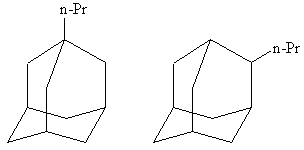
Помимо оптической, для замещенных адамантанов характерна структурная изомерия, в зависимости от того к узловому или к мостиковому атому углерода присоединен заместитель. Например, возможны 1- и 2- пропиладамантаны, соответственно:
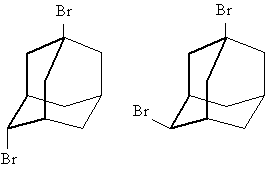
Для дизамещенных производных адамантана с одним мостиковым заместителем пространственная ориентация этого заместителя может быть аксиальной (а) или экваториальной (е), в зависимости от расположения заместителя по отношению к плоскости общего для обоих заместителей циклогексанового кольца (на рисунке выделено жирным) или ее можно обозначить как цис- и транс-. Например, для 1,3-дибромадамантана, возможны два изомера: 1,3а-дибромадамантан и 1,3е-дибромадамантан, соответственно:
Получение адамантана и его алкилпрозводных
Единственным природным продуктом, содержащим адамантан и его гомологи, является нефть. Впервые адамантан был получен при исследовании нефти Годонинского месторождения (бывшая Чехословакия) в 1933 С.Ландой и В.Махачеком. Однако вследствие низкого содержания адамантана в нефти (оно обычно не превышает 0,001% масс.) получение его из этого сырья нецелесообразно. Количество адамантана в различных видах нефти зависит от ее химической природы нефти. Наиболее высое содержание адамантана в нефти нафтенового типа. Напротив, парафинистая нефть содержит адамантан в значительно меньших количествах. В нефти есть и алкильные производные адамантана, в частности, 1-метил, 2-метиладамантаны и 1-этиладамантан.
Так как выделение адамантана из нефти осложнено его низким содержанием, были разработаны методы химического синтеза этого вещества.
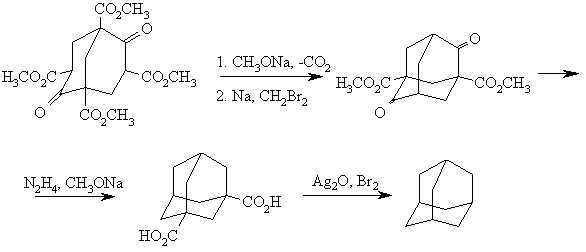
Впервые адамантан синтетическим путем удалось получить в 1941 швейцарцу Прелогу по следующей схеме:
Однако общий выход адамантана составил всего 1,5 %. Были предложены улучшенные варианты вышеприведенного синтеза, но сложность синтеза, а также практическая невозможность синтеза замещенных адамантанов, ограничивает препаративную ценность этого метода.
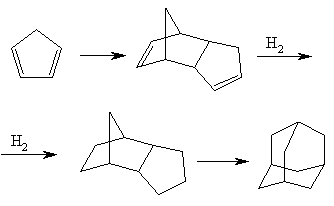
Промышленно пригодный метод синтеза адамантана из легко доступного сырья был предложен и осуществлен Шлейером в 1957. Метод заключается в каталитической изомеризации трициклического углеводорода (по систематической номенклатуре – трицикло [5,2,1,02,6] декана) в адамантан:
Метод практически интересен, поскольку циклопентадиен – вполне доступное вещество, (его получают при крекинге нефтяных фракций как побочный продукт) и легко димеризуется. В зависимости от применяемого катализатора выходы адамантана изменяются в широком интервале. В качестве катализаторов могут применяться различные сильные кислоты Льюиса, такие как AlCl3, SbF5. Выходы колеблются от 15 до 40%.
Этот метод пригоден и для синтетического получения различных алкил замещенных адамантанов:
Характерно, что наличие алкильных групп существенно увеличивает выход конечных продуктов изомеризации.
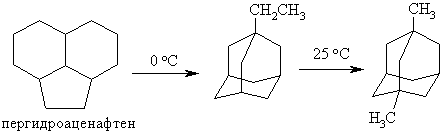
Высокий выход алкиладамантанов получают при изомеризации (над галогенидами алюминия или комплексами на их основе) трициклических пергидроароматических углеводородов состава С12–С14: пергидроаценафтена, пергидрофлуорена, пергидроантрацена и других углеводородов.
Выход в последней реакции составляет 96%.
Доступность исходных соединений (соответствующие ароматические углеводороды в значительных количествах легко выделяются из жидких продуктов коксования каменного угля), высокий выход конечных продуктов изомеризации делают этот метод промышленно привлекательным.
В описанных методах жидкофазной каталитической изомеризации применяются катализаторы (AlCl3, SbF5), которые обладают рядом существенных недостатков: повышенная коррозионная активность, нестабильность, невозможность регенерации, образование в процессе реакции значительных количеств смолы. Это послужило поводом для исследования изомерных превращений полициклоалканов с использованием стабильных гетерогенных катализаторов кислотного типа, получаемых на основе оксидов металлов. Были предложены катализаторы на базе оксида алюминия, которые позволяют получать алкиладамантаны с выходами до 70%.
Каталитические методы изомеризации полициклоалканов – эффективные методы получения углеводородов ряда адамантана, многие из них имеют препаративное значение, а процесс получения адамантана изомеризацией гидрированного димера циклопентадиена реализуется в промышленном масштабе.
Однако по мере повышения молекулярной массы и увеличения числа циклов в исходном углеводороде скорость перегруппировки в адамантаноидные углеводороды замедляется. В ряде случаев методы изомеризации не дают желаемого результата. Так, с их помощью нельзя получить 2-замещенные алкил- и ариладамантаны, кроме того, продукты реакции, как правило, состоят из смеси нескольких изомеров, и нужно их разделить, поэтому широкое развитие приобрели синтетические методы получения углеводородов ряда адамантана, основанные на применении функциональных производных адамантана в качестве исходных веществ, а также методы циклизации – построения структуры адамантана, исходя из алифатических моно- и бициклических соединений. Синтезы на основе функциональных производных широко используются для получения индивидуальных алкил-, циклоалкил-, и ариладамантанов. Методы циклизации используют обычно при синтезах полифункциональных производных адамантана, углеводородов адамантаноидного строения и их производных.
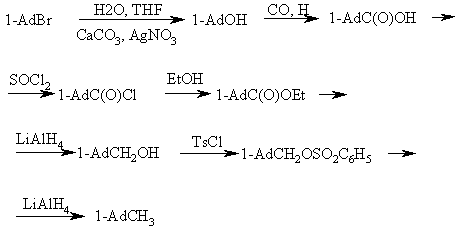
Одним из первых успешных синтезов 1-метиладамантана был многостадийный синтез на основе 1-бромадамантана (обычно адамантильный радикал обозначается в схемах реакций как Ad):
Позднее были найдены и другие более эффективные пути синтеза 1-метиладамантана.
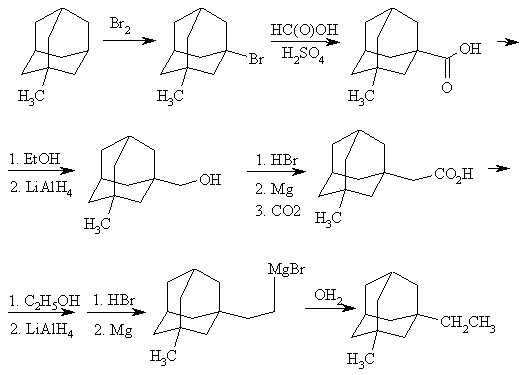
Метод, приведенный ниже можно рассматривать как общий метод синтеза алкиладамантанов, полизамещенных в узловых положениях. Он позволяет путем постепенного наращивания углеводородной цепи получить алкиладамантаны с различной длиной алкильных групп нормального строения.
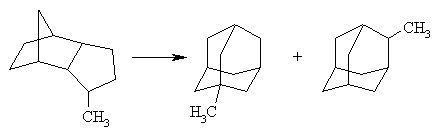
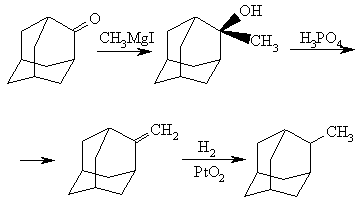
Прямой синтез производных адамантана, замещенных в мостиковые положения, затруднен вследствие низкой реакционной способности мостиковых атомов углерода адамантанового ядра. Для синтеза 2-алкилпроизводных адамантана используют взаимодействие реактивов Гриньяра или алкиллитиевых производных с легко доступным адамантаноном. Так, 2-метиладамантан может быть получен по схеме:
Что касается других методов получения адамантановых структур, то наиболее распространенными являются методы синтеза циклизацией производных бициклононана. Хотя такие методы многостадийны, они позволяют получать производные адамантана с заместителями, которые трудно синтезировать иным путем:
Функционализация узловых положений адаманатанового ядра.
Известно, что насыщенные углеводороды, в том числе и адамантан, характеризуются меньшей по сравнению с ненасыщенными и ароматическими углеводородами реакционной способностью. Это обусловлено предельным характером всех С-С связей, образуемых sp3-гибридизованными атомами углерода. Насыщенные углеводороды каркасного строения также содержат только s-связи, однако такие особенности их строения как наличие нескольких третичных атомов углерода, чередующихся с метиленовыми мостиками, и объемистой структуры клетки увеличивают реакционную способность этих соединений, в особенности в реакциях ионного типа. Относительно высокая реакционная способность адамантана в реакциях ионного типа обусловлена его свойством образовывать достаточно стабильный карбокатион. Образование адамантильного карбокатиона было зафиксировано, в частности, при действии пятифтористой сурьмы на 1-фторадамантан:
Адамантильный катион генерируется и из 1-хлор-, оксиадамантанов в суперкислотах (SbF5) или в «магической кислоте» (SbF5 в HSO3F) в среде SO2 и SO2ClF.
Наиболее употребительные ионные реакции, протекающие в узловых положениях адамантанового ядра:
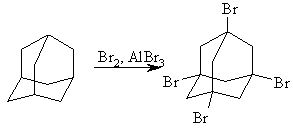
Адамантан и его производные бромируются обычно молекулярным бромом в жидкой фазе, это ионный процесс, катализируемый кислотой Льюиса и нечувствительный к инициаторам радикального типа. Применение катализаторов Фриделя – Крафтса позволяет заместить все четыре атома водорода в узловых положениях адамантанового ядра на бром:
В условиях ионного галогенирования процесс идет селективно по узловым атомам углерода адамантанового ядра.
В отличие от ионного галогенирования, свободнорадикальное галогенирование самого адамантана и его производных приводит к смеси продуктов, состоящих из 1- и 2-замещенных производных.
Для получения фторпроизводных адамантана используют 1-адамантанол:
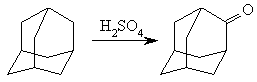
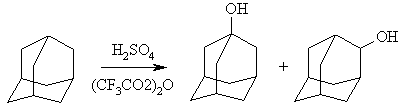
Галогензамещенные адамантана широко используются для синтеза других функционально замещенных адамантанов. Реакционная способность галогенпроизводных адамантана больше, чем у других насыщенных углеводородов. Окисление адамантана серной кислотой представляет собой важный препаративный метод, поскольку позволяет получать адамантанон с высоким выходом:
В тоже время взаимодействие адамантана с концентрированной серной кислотой в среде трифторуксусного ангидрида позволяет получить смесь 1- и 2-адамантанолов, с преимущественным содержанием первого из них:
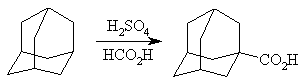
Для синтеза карбоновых кислот адамантанового ряда чаще всего используют реакцию карбоксилирования. Кох и Хааф впервые в 1960 осуществили таким путем прямой синтез 1-адамантанкарбоновой кислоты. Реакцию проводят в среде концентрированной серной кислоты или олеума, что обеспечивает образование адамантилкатионов.
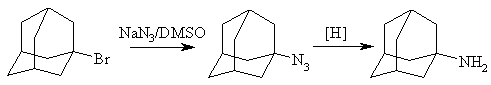
Азотсодержащие производные адамантана чаще всего синтезируют на основе реакций замещения галогена в галогенпроизводных адамантана:
Удобнее получать 1-аминоадамантан можно получать по одностадийной реакции Риттера, заключающейся во взаимодействии самого адамантана или 1-бромадамантана с нитрилом (обычно ацетонитрил) в присутствии трет-бутилового спирта под действием брома в серной кислоте:
Последующий гидролиз образовавшегося амида приводит к 1-аминоадамантану.
Среди реакций функционализации адамантана есть интересный способ активации С-H -связи в адамантановом ядре, предложенный Олой с помощью хлористого алюминия в хлористом метилене в присутствии трехлористого фосфора. В результате реакции образуются дихлорфосфорилированные производные с выходами 40–60%.
Несмотря на необычность структуры адамантана, реакции в которые он вступает, довольно традиционны для органической химии. Особенность же адамантана проявляется за счет либо стерических эффектов, связанных с большим размером адамантильного радикала, либо с возможностью образования относительно устойчивого адамантильного катиона.
Применение.
Перспективность применения производных адамантана обуславливается набором специфических свойств: относительно большой размер адамантильного радикала (его диаметр составляет 5Å), высокая липофильность (растворимость в неполярных растворителях), конформационная жесткость. Последние два свойства особенно важны при создании новых лекарственных препаратов. Введение адамантильного радикала повышает, в целом, термическую стабильность вещества и его стойкость к окислению и радиационному облучению, что важно, в частности, при получении полимеров со специфическими свойствами.
Все это стимулировало широкомасштабный поиск новых лекарственных препаратов, полимерных материалов, присадок к топливам и маслам, взрывчатых веществ, жидких ракетных топлив, неподвижных фаз для газожидкостной хроматографии на основе производных адамантана.
Сейчас сам адамантан не используется, но ряд его производных находит широкое применение.
В наибольшей степени производные адамантана применяются в фармацевтической практике.
Так, препараты ремантадин (гидрохлорид 1-(1-адамантил)этиламина), и адапромин (a-пропил-1-адамантил-этиламина гидрохлорид) используются как лекарства при эффективной профилактике вирусных инфекций, а амантадин (гидрохлорид 1-аминоадамантана) и глудантан (глюкуронид 1-аминоадамантана) эффективны при паркинсонизме, порождаемом различными причинами, в частности, при нейролептическом и посттравматическом синдроме.
Полимерные аналоги адамантана запатентованы как противовирусные соединения, в том числе, в отношении ВИЧ, полимерные аналоги адамантана.
Замещенные амиды адамантанкарбоновой кислоты могут служить снотворными средствами. Введение адамантильного остатка в 2-оксинафтохинон приводит к получению антималярийных препаратов. Адамантиламиноспирты и их соли обладают выраженным психостимулирующим действием и при этом мало токсичны. Некоторые N-(адамант-2-ил)анилины проявляют нейротропную активность, а биологическая активность N-(адамант-2-ил)гексаметиленимина проявляется по отношению к паркинсоническому синдрому.
Алкилпроизводные адамантана, в частности 1,3-диметиладамантан, используются как рабочие жидкости в некоторых гидравлических установках. Целесообразность такого их использования объясняется высокой термической стабильностью диалкилпроизводных, их низкой токсичностью и большой разницей между критической температурой и температурой кипения.
В химии высокомолекулярных соединений введение адамантильного заместителя позволило во многих случаях улучшить эксплуатационные характеристики полимерных материалов. Обычно, полимеры, содержащие в своем составе адамантильный фрагмент, термостойки и их температура размягчения достаточно высока. Они достаточно устойчивы и к гидролизу, окислению, фотолизу. По этим свойствам адамантансодержащие полимерные материалы превосходят многие известные промышленные полимеры и могут найти применение в различных областях техники в качестве конструкционных, электроизоляционных и иных материалов.
Владимир Корольков
Багрий Е.И. Адамантаны: Получение, свойства, применение. М., Наука, 1989
Морозов И.С., Петров В.И., Сергеева С.А. Фармакология адамантанов. Волгоград: Волгоградская мед. академия, 2001
Ответь на вопросы викторины «Неизвестные подробности»