ОЧИСТКА ВОДЫ
ОЧИСТКА ВОДЫ. То, что вода может способствовать распространению болезней, знали еще древние греки. Реформатор античной медицины врач Гиппократ (ок. 460 – ок. 370 до н.э.) советовал кипятить или фильтровать загрязненную воду, прежде чем пить. Тем не менее, даже 150 лет назад многие люди еще не верили в то, что болезни могут распространяться с водой и поэтому, не задумываясь, сбрасывали все отходы в ту же реку, из которой они или их соседи брали воду для питья.
В 1872 было обнаружено, что фильтрование воды через слой песка является хорошим способом ее очистки и делает ее относительно безопасной для питья. В начале 20 в. в практику было введено химическое обеззараживание воды с помощью хлора или его соединений. Сначала использовали гипохлориты кальция или натрия, позднее их заменили газообразным хлором.
Без специальной обработки использовать для питья можно только воду из глубинных источников, по согласованию с органами санитарно-эпидемиологической службы (СЭС). Без специального разрешения СЭС нельзя использовать родниковую воду, особенно из родников, находящихся в черте крупных городов и вблизи промышленных предприятий.
Некоторые природные воды с повышенным содержанием растворенных веществ (минеральные воды) используются в лечебных целях.
Для использования природной воды из других источников в качестве питьевой, ее предварительно очищают, при этом удаляются как болезнетворные организмы, так и вредные химические вещества. Кроме того, очистка воды предназначена для того, чтобы сделать ее приятной на вкус.
Чтобы в систему водоснабжения не попали рыба, мусор и различные крупные предметы, на пути воды ставят фильтр грубой очистки – сетку. Неприятный вкус и запах могут быть удалены с помощью аэрации – насыщения воды кислородом воздуха. Для этого воду разбрызгивают при помощи ряда фонтанов или пропускают через сетку. Это способствует удалению растворенных в ней газов, например сероводорода. Затем проводят первое хлорирование.
Вода рек, водохранилищ и озер обычно бывает мутной, так как в ней содержится большое количество взвешенных частиц. Чтобы их удалить (осветлить воду), к ней добавляют соли алюминия или железа. Образующаяся хлопьевидная масса гидроксида алюминия или железа захватывает частицы примесей. На этой стадии очистки нередко добавляют небольшое количество крошки активированного угля. После отстаивания воду фильтруют через слой песка и сетчатые фильтры.
Наличие в воде болезнетворных микроорганизмов и вирусов делает ее непригодной для питья, поэтому воду еще раз дезинфицируют. Чаще всего для этого используют хлор, который, будучи сильным окислителем, убивает опасные микроорганизмы. Хлор взаимодействует также с аммиаком, который может содержаться в воде. Хлор добавляется в избытке, по сравнению с уровнем, при котором гибнут все микроорганизмы и окисляется присутствующий в воде аммиак. Избыток хлора можно легко определить с помощью иод-крахмального теста. К недостаткам хлорирования относится возможность взаимодействия хлора с растворенными в воде углеводородами с образованием хлорированных углеводородов, некоторые из них канцерогенны. Для обеззараживания воды используют также озонирование и ультрафиолетовое облучение. Озон не создает постороннего вкуса и запаха, разрушает углеводороды, однако продукты реакций озона с органическими веществами, содержащимися в воде, например, альдегиды, представляют определенную опасность для здоровья. Поэтому, чтобы окислить органические примеси полностью (до углекислого газа и воды), при озонировании должен использоваться заведомый избыток озона. Важно, что озон более дорогой окислитель, чем хлор.
Вода, очищенная на современных водопроводных станциях, например в Москве, соответствует Государственному стандарту. Качество такой воды вполне достаточно, чтобы не использовать бытовые фильтры, которые зачастую способствуют не дополнительной очистке, а, наоборот, загрязнению микроорганизмами, размножающимися на применяемых в фильтрах сорбентах.
Пресная природная вода может быть жесткой или мягкой. При нагревании жесткой воды на стенках сосуда образуется накипь, представляющая собой смесь малорастворимых карбонатов. Это приводит, в частности, к нарушению работы водяных котлов и теплосетей. В жесткой воде мыло не образует пену, плохо развариваются овощи, не заваривается чай. Жесткость воды определяется присутствием катионов кальция и магния. Гидрокарбонаты этих металлов создают временную, а хлориды и сульфаты – постоянную жесткость. Существуют различные способы устранения жесткости воды.
|
СПОСОБЫ УСТРАНЕНИЯ ЖЕСТКОСТИ ВОДЫ
|
|
| Временная жесткость | Постоянная жесткость |
| Ca(HCO3)2, Mg(HCO3)2 | CaSO4, MgSO4, CaCl2, MgCl2 |
|
Действие растворимых карбонатов
|
|
| Ca(HCO3)2 + Na2CO3 = CaCO3¯ + 2NaHCO3 | CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl |
| Кипячение Ca(HCO3)2 = CaCO3¯ + H2O + CO2 |
|
| Действие сильных оснований Ca(HCO3)2 + Ca(OH)2 = 2CaCO3¯ + 2H2O |
|
Применяют и другие способы умягчения воды, например, с помощью органических реагентов. Нередко природную воду дополнительно фторируют (добавляя соли фтороводородной кислоты).
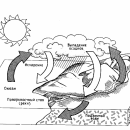
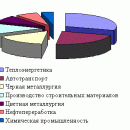
Чтобы выжить, человеку нужно около 1,5 л воды в сутки. Однако расход воды в расчете на каждого горожанина ежесуточно составляет до 600 л воды. Много воды потребляет промышленность. В общей сложности на производственные и бытовые нужды расходуется около 10% общего объема речных вод. Взамен в природные водоемы поступает огромное количество сельскохозяйственных, промышленных и бытовых стоков.
Наша страна располагает огромными запасами пресной воды, в том числе речными водами, наиболее удобными практически для всех направлений потребления. Достаточно велики и запасы подземных вод. Однако
объем речного стока сильно зависит от колебаний климата и времени года.
Кроме того, водные ресурсы распределены на территории России крайне
неравномерно. В Европейской части страны, где проживает около 3/4 населения, сконцентрированы предприятия промышленности и сельского хозяйства, речной сток не превышает 25% от общего стока.
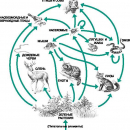
Несмотря на огромные расходы воды, в обозримом будущем ее недостаток в нашей стране не предвидится. Более реальна значительная потеря ресурсов пресной воды вследствие сброса в природные резервуары недостаточно очищенных сточных вод. Такое понятие, как «загрязнение воды» понимается по-разному. Для одних – это наличие в воде ядовитых химических веществ, для других – болезнетворные микробы. Однако для многих специалистов уровень загрязнения воды определяется присутствием органических отходов. Источниками таких отходов могут быть фабрики и заводы, сельскохозяйственные предприятия, города. При попадании в природные водоемы органических веществ с бытовыми и промышленными сточными водами концентрация растворенного кислорода в воде уменьшается в результате их окисления бактериями и простейшими. Это приводит к гибели водных организмов и снижению качества воды.
Загрязняющими веществами являются также фосфаты и нитраты. Для повышения урожайности на поля вносят различные минеральные удобрения. Соединения азота и фосфора накапливаются в озерах и водохранилищах, где начинается бурное развитие водорослей, а затем – разложение растительных остатков. Поглощение кислорода при дыхании водорослей и гниение их остатков приводит к тому, что содержание кислорода в воде может упасть ниже уровня, необходимого для жизнедеятельности других водных организмов. Загрязнение природных вод азотсодержащими соединениями может привести к повышению их концентрации в продуктах питания и питьевой воде, а это наносит вред здоровью.
Загрязнение природных вод представляет опасность для жизни на Земле, поэтому нельзя допускать сброс неочищенных сточных вод в природные водоемы. Борьба с загрязнением воды направлена на восстановление ее качеств, которые были утрачены ею при использовании потребителями.
Технология очистки сточных вод включает несколько этапов. Сначала сточные воды очищают от нерастворимых примесей. Крупные предметы удаляют фильтрованием воды через решетки и сетки, затем вода поступает в отстойник, где постепенно оседают мелкие частицы.
Для удаления растворенных органических веществ, аммиака и катионов аммония их окисляют с помощью бактерий. Процесс протекает более интенсивно в условиях аэрации. Нитраты превращают в газообразный азот с использованием особых микроорганизмов. Соединения фосфора осаждают в виде малорастворимого ортофосфата кальция, который образуется при добавлении извести (оксида или гидроксида кальция).
После повторного отстаивания, поглощения оставшихся примесей активированным углем и дезинфекции сточные воды можно возвращать в природные водоемы или повторно использовать для хозяйственных нужд. Образовавшиеся твердые отходы высушивают, а затем сжигают или вывозят на утилизацию. Из содержащихся в них веществ можно получить горючие газы, удобрения и другие полезные продукты.
Чтобы сократить потребление свежей воды, разрабатывают новые малоотходные технологии, внедряют воздушное охлаждение вместо водяного, применяют повторное использование воды. Однако сброс сточных вод в окружающую среду не прекращается. Это не только опасно для водных организмов, но и приводит к ухудшению качества питьевой воды. Предотвращение загрязнения воды остается одной из самых важных задач охраны окружающей среды.
Елена Савинкина
Ревель П., Ревель Ч. Среда нашего обитания. В четырех книгах (перевод с англ.). М., Мир, 1995
Химия и общество (перевод с англ.). М., Мир, 1995
Добровольский В.В. Основы биогеохимии. Учеб. пособие для геогр., биол., геол., с.-х. спец. вузов. М., Высш. шк., 1998
Андруз Дж., Бримблекумб П., Джикелз Т., Лисс П. Введение в химию окружающей среды (перевод с англ.). М., Мир, 1999
Ответь на вопросы викторины «Неизвестные подробности»