АЗОТНЫЕ УДОБРЕНИЯ
АЗОТНЫЕ УДОБРЕНИЯ.
Азот и жизнь.
Французское название элемента (azote), которое прижилось и в русском языке, предложил в 18 в. Лавуазье, образовав его от греческой отрицательной приставки «а» и слова «зоэ» – жизнь (тот же корень в словах зоология и массе его производных – зоопарк, зоогеография и т.д.), т.е. «азот» означает «безжизненный», «не поддерживающий жизни». Того же происхождения и немецкое название этого элемента Stickstoff – удушливое вещество. Корень «азо» присутствует и в химических терминах «азид», «азосоединение», «азин» и др. А латинское nitrogenium и английское nitrogen происходят от древнееврейского «нетер» (греч. «нитрон», лат. nitrum); так в древности называли природную щелочь – соду, а позднее – селитру. Название «азот» не вполне удачное: хотя газообразный азот и не пригоден для дыхания, для жизни этот элемент совершенно необходим. В состав всех живых существ входит относительное небольшое число элементов и один из важнейших из них – азот, в белках – около 17% азота. Входит азот и в состав молекул ДНК и РНК, обеспечивающих наследственность.
Азота на Земле много, но основные его запасы сосредоточены в атмосфере. Однако из-за высокой прочности тройной связи NєN (942 кДж/моль, что почти в 4 раза больше энергии связи Cl–Cl) молекула азота очень прочная, а ее реакционная способность низка. В результате ни одно животное или растение не способны усвоить газообразный азот из воздуха. Откуда же они получают этот элемент, необходимый им для синтеза белков и других важнейших компонентов организма? Животные получают азот в результате поедания растений и других животных. Растения извлекают азот вместе с другими питательными веществами из почвы, и лишь немногие бобовые растения могут усваивать азот из воздуха – и то не сами, а благодаря клубеньковым бактериям, живущим на их корнях.
Основной источник азота в почве – биологическая азотофиксация, т.е связывание атмосферного азота и перевод его микроорганизмами в усвояемые растениями формы. Микроорганизмы могут жить в почве сами по себе, а могут находиться в симбиозе («содружестве») с некоторыми растениями, в основном, с бобовыми – клевером, горохом, фасолью, люцерной и др. Бактерии «поселяются» на корнях этих растений – в особых клубеньках; часто их так и называют – клубеньковые бактерии. В этих микроорганизмах содержится сложный фермент нитрогеназа, способный восстановить азот до аммиака. Затем с помощью других ферментных систем аммиак превращается в другие соединения азота, которые усваиваются растениями. Свободно живущие бактерии связывают до 50 кг азота в год в расчете на 1 га, а клубеньковые – еще 150 кг, а в особо благоприятных условиях – до 500 кг!
Второй источник природного азота в почве – это молнии. Ежесекундно на Земном шаре вспыхивает в среднем 100 молний. И хотя каждая из них длится всего доли секунды, их общая электрическая мощность достигает 4 млрд. киловатт. Резкое повышение температуры в канале молнии –до 20 000° С приводит к разрушению молекул азота и кислорода с образованием оксида азота NO. Далее он окисляется атмосферным кислородом в диоксид: 2NO + O2 2NO2. Диоксид, реагируя при избытке кислорода с атмосферной влагой, превращается в азотную кислоту: 4NO2 + 2H2O + O2 4HNO3. В результате этих превращений в атмосфере ежедневно образуется примерно 2 млн. т азотной кислоты или более 700 млн т в год. Слабый раствор азотной кислота выпадает на землю с дождями. Это количество «небесной кислоты» интересно сравнить с ее промышленным производством; получение азотной кислоты – одно из самых крупнотоннажных производств. Оказывается, здесь человек далеко отстает от природы: мировое производство азотной кислоты составляет около 30 млн. т. За счет расщепления молекул азота молниями на каждый гектар земной поверхности, включая горы и пустыни, моря и океаны, ежегодно выпадает около 15 кг азотной кислоты. В почве эта кислота переходит в ее соли – нитраты, которые прекрасно усваиваются растениями.
Казалось бы, «грозовой азот» не так уж важен для посевов, однако клевер и другие бобовые покрывают лишь малую часть земной поверхности. Молнии же начали сверкать в атмосфере миллиарды лет назад, задолго до появления азотфиксирующих бактерий. Так что они сыграли заметную роль в связывании атмосферного азота. Например, только за последние два тысячелетия молнии перевели в удобрения 2 триллиона тонн азота – примерно 0,1% всего его количества в воздухе!
Либих против Мальтуса. В 1798 году английский экономист Томас Мальтус (1766–1834) издал свою знаменитую книгу Опыт о народонаселении. В ней он указал, что численность населения имеет тенденцию возрастать в геометрической прогрессии, т.е. как 1, 2, 4, 8, 16... В то же время средства к существованию за те же промежутки времени даже в самых благоприятных условиях могут расти только в арифметической прогрессии, т.е. как 1, 2, 3, 4... Например, по этой теории производство продуктов питания может расти лишь путем расширения сельскохозяйственных угодий, лучшей обработке пахотной земли и т.д. Из теории Мальтуса следовало, что в будущем человечеству грозит голод. В 1887 этот вывод подтвердил английский ученый Томас Гексли (1825–1897), друг Чарлза Дарвина и популяризатор его учения.
Чтобы избежать «голодной смерти» человечества, необходимо было резко увеличить производительность сельского хозяйства, а для этого надо было решить важнейший вопрос о питании растений. Вероятно, первый опыт в этом направлении провел в начале 1630-х один из крупнейших ученых своего времени, голландский врач и алхимик Ян Батист ван Гельмонт (1579–1644). Он решил проверить, откуда растения получают питательные вещества – из воды или из почвы. Ван Гельмонт взял 200 фунтов (ок. 80 кг) сухой земли, насыпал ее в большой горшок, посадил в землю ветку ивы и принялся усердно поливать ее дождевой водой. Ветка пустила корни и начала расти, превращаясь постепенно в деревце. Этот опыт продолжался ровно пять лет. Оказалось, что за это время растение прибавило в массе 164 фунта 3 унции (около 66 кг), тогда как земля «похудела» всего на 3 унции, т.е. меньше, чем на 100 г. Следовательно, сделал вывод Ван Гельмонт, растения берут питательные вещества только из воды.
Последующие исследования этот вывод как будто опровергли: ведь в воде нет углерода, который составляет основную массу растений! Отсюда следовало, что растения буквально «питаются воздухом», поглощая из него углекислый газ – тот самый, который как раз открыл Ван Гельмонт и даже назвал его «лесным воздухом». Такое название было дано газу вовсе не потому, что его много в лесах, а лишь благодаря тому, что он образуется при горении древесного угля...
Вопрос «воздушного питания» растений развил в конце 18 в. швейцарский ботаник и физиолог Жан Сенебье (1742–1809). Он экспериментально доказал, что в листьях растений происходит разложение углекислого газа, при этом кислород выделяется, а углерод остается в растении. Но некоторые ученые резко возражали против этой точки зрения, отстаивая «гумусовую теорию», согласно которой растения питаются в основном извлекаемыми из почвы органическими веществами. Это как будто подтверждала вековая практика ведения сельского хозяйства: почва, богатая перегноем, хорошо удобренная навозом, давала повышенные урожаи...
Однако теория гумуса не учитывала роль минеральных веществ, которые растениям совершенно необходимы. Эти вещества растения извлекают из почвы в большом количестве, и при уборке урожая они уносятся с полей. Впервые на это обстоятельство, а также на необходимость возвращать в почву минеральные вещества указал немецкий химик Юстус Либих. В 1840 он выпустил книгу Органическая химия в применении к земледелию и физиологии, в которой, в частности, писал: «Придет время, когда каждое поле, сообразно с растением, которое на нем будут разводить, будет удобряться свойственным удобрением, приготовленном на химических заводах».
Поначалу идеи Либиха были приняты в штыки. «Это самая бесстыдная книга из всех, которые когда-либо попадали мне в руки», – писал о ней профессор ботаники Тюбингенского университета Гуго Моль (1805–1872). «Совершенно бессмысленная книга», – вторил ему известный немецкий писатель Фриц Рейтер (1810–1874), занимавшийся некоторое время сельским хозяйством. Немецкие газеты начали помещать оскорбительные письма и карикатуры на Либиха и его теорию минерального питания растений. Частично виноват в этом был и сам Либих, который сначала ошибочно полагал, что минеральные удобрения должны содержать только калий и фосфор, тогда как третий необходимый компонент – азот – растения сами могут усваивать из воздуха.
Ошибка Либиха, вероятно, объяснялась неправильной интерпретацией опытов известного французского агрохимика Жана Батиста Буссенго (1802–1887). В 1838 он посадил взвешенные семена некоторых растений в почву, не содержащую азотных удобрений, а через 3 месяца взвесил ростки. У пшеницы и овса масса практически не изменилась, тогда как у клевера и гороха она значительно увеличилась (у гороха, например, с 47 до 100 мг). Отсюда был сделан неверный вывод о том, что некоторые растения могут усваивать азот прямо из воздуха. О клубеньковых бактериях, живущих на корнях бобовых и улавливающих атмосферный азот, в то время ничего не знали. В результате первые попытки применить лишь калийно-фосфорные удобрения повсеместно дали отрицательный результат. У Либиха хватило мужества открыто признать свою ошибку. Его теория в конце концов победила. Результатом было введение в сельское хозяйство со второй половины 19 в. химических удобрений и строительство заводов по их производству.
Азотный кризис.
С фосфорными и калийными удобрениями особых проблем не было: в недрах земли соединения калия и фосфора содержатся в изобилии. Совершенно иначе дело обстояло с азотом: с интенсификацией сельского хозяйства, которое должно было прокормить быстро растущее население Земли, естественные источники перестали справляться с пополнением запасов азота в почве. Возникла настоятельная потребность изыскать источники «связанного» азота. Химики умели синтезировать некоторые соединения, например, нитрид лития Li3N, исходя из атмосферного азота. Но так можно было получить граммы, в лучшем случае – килограммы вещества, тогда как требовались миллионы тонн!
В течение многих веков практически единственным источником связанного азота была селитра. Это слово происходит от латинских sal – соль и nitrum, дословно – «щелочная соль»: в те времена состав веществ был неизвестен. В настоящее время селитрой называют некоторые соли азотной кислоты – нитраты. С селитрой связаны несколько драматических вех в истории человечества. С древних времен была известна только так называемая индийская селитра – нитрат калия KNO3. Этот редкий минерал привозили из Индии, тогда как в Европе природных источников селитры не было. Индийскую селитру использовали исключительно для производства пороха. Пороха с каждым столетием требовалось все больше, а привозной селитры не хватало, и была она очень дорога.
Со временем селитру научились получать в специальных «селитряницах» из различных органических остатков, которые содержат азот. Довольно много азота, например, в белках. Если сухие остатки просто сжечь, содержащийся в них азот в основном окислится до газообразного N2. Но если они подвергаются гниению, то под действием нитрифицирующих бактерий азот переходит в нитраты, которые и выщелачивали в старину в специальных кучах – буртах, а селитру называли буртовой. Делали это так. Смешивали различные органические отходы – навоз, внутренности животных, ил, болотную жижу и т.п. Туда же добавляли мусор, известь, золу. Эту жуткую смесь засыпали в ямы или делали из нее кучи и обильно поливали мочой или навозной жижей. Можно представить себе, какой запах шел от этого производства! За счет процессов разложения в течение одного – двух лет из 6 кг «селитряной земли» получали 1 кг селитры, которую очищали от примесей. Больше всего селитры получали во Франции: правительство щедро награждало тех, кто занимался этим неприятным производством.
Благодаря стараниям Либиха стало очевидным, что селитра потребуется сельскому хозяйству, причем в значительно больших количествах, чем для производства пороха. Старый способ ее получения для этого совершенно не годился.
Чилийская селитра.
С 1830 началась разработка залежей чилийской селитры – богатейшего природного источника азота. В Чили есть огромные пространства, в которых никогда не бывает дождей, например, пустыня Атакама, расположенная в предгорьях Кордильер на высоте около 1000 м над уровнем моря. В результате тысячелетних процессов разложения растительных и животных органических остатков (в основном птичьего помета – гуано) в Атакаме образовались уникальные залежи селитры. Они расположены в 40–50 км от берега океана. Когда эти залежи начали разрабатывать, они тянулись полосой длиной около 200 км и шириной 3 км при толщине пласта от 30 см до 3 м. В котловинах пласты значительно утолщались и напоминали высохшие озера. Как показали анализы, чилийская селитра – это нитрат натрия с примесями сульфата и хлорида натрия, глины и песка; иногда в селитре находят неразложившиеся остатки гуано. Интересной особенностью чилийской селитры является присутствие в ней иодата натрия NaIO3.
Обычно порода была мягкая и легко извлекалась из земли, но иногда залежи селитры были такими плотными, что для их извлечения требовались взрывные работы. После растворения породы в горячей воде раствор фильтровали и охлаждали. При этом в осадок выпадал чистый нитрат натрия, который шел на продажу в виде удобрения. Из оставшегося раствора добывали иод. В 19 в. Чили стало главным поставщиком селитры. Разработка месторождений занимала первое место в горнодобывающей промышленности Чили 19 в.
Чтобы получить из чилийской селитры нитрат калия, использовали реакцию NaNO3 + KCl ® NaCl + KNO3. Такая реакция возможна благодаря резкому различию в растворимости ее продуктов при разных температурах. Растворимость NaCl (в граммах на 100 г воды) изменяется лишь с 39,8 г при 100° С до 35,7 г при 0° С, тогда как растворимость KNO3 при тех же температурах отличается очень сильно и составляет 246 и 13,3 г! Поэтому если смешать горячие концентрированные растворы NaNO3 и KCl, а затем охладить смесь, то значительная часть KNO3 выпадет в осадок, а почти весь NaCl останется в растворе.
В течение десятков лет чилийская селитра – природный нитрат натрия удовлетворял потребности человека. Но как только выявилось уникальное значение этого минерала для мирового сельского хозяйства, стали подсчитывать, на сколько же хватит человечеству этого уникального дара природы. Первые подсчеты были довольно оптимистическими – в 1885 запас селитры определялся в 90 млн. т. Получалось, что можно не беспокоиться об «азотном голодании» растений еще много лет. Но эти расчеты не учитывали быстрый рост населения и темпов сельскохозяйственного производства во всем мире.
Во времена Мальтуса экспорт чилийской селитры составлял всего 1000 т в год; в 1887 он достиг 500 тыс. т в год, а в начале 20 в. исчислялся уже миллионами тонн! Запасы чилийской селитры быстро истощались, тогда как потребность в нитратах росла исключительно быстро. Положение усугублялось тем, что селитру в больших количествах потребляла и военная промышленность; порох конца 19 в. содержал 74–75% калиевой селитры. Требовалось разработать новые методы получения азотных удобрений, причем их источником мог быть только атмосферный воздух.
Преодоление «азотного голода».
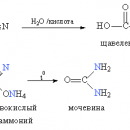
В начале 20 в. для промышленного связывания азота был предложен цианамидный метод. Сначала накаливанием смеси извести и угля получали карбид кальция: СаО + 3С ® СаС2 + СО. При высокой температуре карбид реагирует с азотом воздуха с образованием цианамида кальция: CaC2 + N2 ® CaCN2 + C. Это соединение оказалось годным в качестве удобрения не для всех культур, поэтому из него действием перегретого водяного пара стали получать сначала аммиак: CaCN2 + 3H2O ® CaCO3 + 2NH3, а из аммиака и серной кислоты получали уже сульфат аммония.
Совершенно другим способом пошли норвежские химики, которые использовали дешевую местную электроэнергию (в Норвегии много гидроэлектростанций). Они фактически воспроизвели природный процесс связывания азота, пропуская влажный воздух через электрическую дугу. При этом из воздуха получалось около 1% азотной кислоты, которую взаимодействием с известью переводили в нитрат кальция Ca(NO3)2. Не удивительно, что это вещество назвали норвежской селитрой.
Однако оба метода были слишком дороги. Наиболее экономичный метод связывания азота разработал в 1907–1909 немецкий химик Фриц Габер (1868–1934); по этому методу азот превращается непосредственно в аммиак; превратить аммиак в нитраты и другие соединения азота было уже несложно.
В настоящее время производство азотных удобрений исчисляется десятками миллионов тонн в год. В зависимости от химического состава они бывают разных типов. Аммиачные и аммонийные удобрения содержат азот в степени окисления –3. Это жидкий аммиак, его водный раствор (аммиачная вода), сульфат аммония. Ионы NH4+ под действием нитрифицирующих бактерий окисляются в почве в нитрат-ионы, которые хорошо усваиваются растениями. К нитратным удобрениям относятся KNO3 и Ca(NO3)2. К аммонийно-нитратным удобрениям относится прежде всего аммиачная селитра NH4NO3, содержащая одновременно аммиачный и нитратный азот. Самое концентрированное твердое азотное удобрение – карбамид (мочевина), содержащее 46% азота. Доля же природной селитры в мировом производстве азотсодержащих соединений не превышает 1%.
Применение.
Выведение новых сортов растений, в том числе и генетически модифицированных, усовершенствованные приемы агротехники не отменяют необходимости применения искусственных удобрений. Ведь с каждым урожаем поля теряют значительную долю питательных веществ, в том числе и азота. По данным многолетних наблюдений каждая тонна азота в азотных удобрениях дает прибавку урожая пшеницы на 12–25%, свеклы – на 120–160%, картофеля – на 120%. В нашей стране за последние полвека производство азотных удобрений наneазотно-туковых заводах увеличилось в десятки раз.
Илья Леенсонne
Позин М.Е. Технология минеральных удобрений. Л., Химия, 1983
Штрубе В. Пути развития химии. Том 2. М., Мир, 1984
Ответь на вопросы викторины «Животные»