ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА
ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. Автономные (переносные) химические источники тока подразделяются на первичные (гальванические элементы) и вторичные (аккумуляторы). Первичные источники после их истощения не заряжаются, а выбрасываются. Не удивительно, что их стоимость значительно ниже, чем у аккумуляторов, которые служат, например, в мобильных телефонах. Однако принцип действия у них один – окислительно-восстановительная химическая реакция, при которой электроны, переходящие от восстановителя к окислителю, и есть электрический ток.
До изобретения гальванических элементов единственным источником электричества были электрические электростатические машины (название происходит от греческого слова «электрон» – янтарь; с древности была известна способность кусков янтаря заряжаться при трении и притягивать легкие предметы). В этих машинах электрический заряд возникает за счет трения. Затем появились индукционные машины, в которых заряды появлялись на вращающихся в противоположные стороны стеклянных дисках и накапливались на двух металлических шарах – разрядниках (такие машины можно увидеть и в школьном кабинете физики). Когда напряжение на разрядниках превышает напряжение пробоя воздуха (примерно 30 киловольт/см), проскакивает искра и слышен треск; аналогичное явление в большом масштабе происходит и при разряде «настоящей» молнии. Такие машины позволяли проделывать некоторые опыты (например, с помощью искры можно было поджечь эфир), однако они не могли давать электрический ток в течение хотя бы нескольких секунд. В 1745–1746 немецкий физик Эвальд Юрген фон Клейст и голландский физик Питер ван Мушенбрук, работавшие в городе Лейдене, создали простой прибор, позволяющий сохранять электрический заряд, полученный от электростатической машины. Это был прообраз современных конденсаторов, который назвали лейденской банкой. Он тоже мог давать только кратковременный разряд.
Созданию постоянных источников тока содействовало открытие, сделанное в конце XVIII в. итальянским профессором анатомии Луиджи Гальвани. Гальвани препарировал лягушку, а неподалеку стояла электростатическая машина. Когда острие скальпеля коснулось бедренных нервов, то, как писал Гальвани, «немедленно все мышцы конечностей начали так сокращаться, что казались впавшими в сильнейшие тонические судороги». Помощник Гальвани заметил, что в этот самый момент между полюсами машины проскочила искра.
Такие же результаты были впоследствии получены и на других животных и не только холоднокровных. Электрическую машину в опыте с лягушкой вполне мог заменить разряд в лейденской банке и, как впоследствии выяснилось, атмосферный разряд – молния. Гальвани объяснил это необычное явление существованием некоего «животного электричества». По его мнению, мышцы и нервы образуют как бы две обкладки лейденской банки и могут накапливать электричество. Действительно, так и происходит у электрических рыб и скатов: у них имеются довольно емкие природные конденсаторы. Но это стало известно намного позже. Гальвани же, сам того не подозревая, предвосхитил опыты немецкого физика Генриха Рудольфа Герца, который с помощью искры получил радиоволны, а затем смог их принять на отдалении нескольких метров. Только у Герца приемником служил проволочный прямоугольник – антенна с искровым промежутком (очень слабые искорки в приемнике он наблюдал в темноте или с помощью лупы), тогда как у Гальвани роль антенны выполнял скальпель, а детектором был нерв лягушки.
Однако в некоторых опытах лягушачьи мышцы сокращались без всяких видимых причин: ни грозы, ни электрической машины поблизости не было. Оказалось, что это происходит в тех случаях, когда мышца и нерв соединены металлической проволокой, и особенно сильно – если эта проволока составлена из двух разных металлов; сильнее других действовала пара железо-серебро.
Раскрыть природу открытого Гальвани явления удалось итальянскому физику Алессандро Вольта. Вначале он вообще не поверил Гальвани, но, повторив его опыты, убедился в том, что явление действительно существует. Однако опыты с проволокой он объяснил совершенно иначе: электричество возникает при контакте разных металлов, а лягушка – это просто очень чувствительный прибор для измерения и к образованию электричества как такового отношения не имеет. Опытным путем Вольта расположил металлы в ряд таким образом, что чем дальше друг от друга отстоят они в этом ряду, тем более сильный эффект производят. Химики с удивлением обнаружили, что в таком же порядке изменяется и химическая активность металлов. В настоящее время этот ряд называется рядом напряжений или, точнее, рядом электродных потенциалов. В основных чертах он имеет вид Li...Mg...Zn...Fe...Sn...H...Cu...Ag...Au
Вольта, помимо лягушки, использовал и другие способы измерения, например, собственный язык: он клал на него золотую или серебряную монету, а под язык – медную. Как только две монеты соединяли кусочком проволоки, сразу же во рту ощущался кислый вкус, знакомый каждому, кто пробовал «на язык» контакты батарейки для карманного фонаря. Чтобы усилить эффект, Вольта соединял пары металлов последовательно, так что получилась цепочка, названная по имени изобретателя «вольтовым столбом». Сначала это были чашечки с раствором кислоты, в которую были опущены металлические полоски, затем – кружочки из цинка и меди (или серебра), разделенные прокладками из бумаги или ткани, которые были пропитаны раствором щелочи или просто рассолом.
Введение в электрическую цепь растворов (Вольта назвал их проводниками второго рода в отличие от металлов – проводников первого рода) оказалось решающим в изобретении Вольта. В память о Гальвани, умершем в 1798, Вольта назвал свои элементы гальваническими. Вскоре английский хирург и химик Энтони Карлейль изготовил вольтов столб из 36 последовательно соединенных цинковых кружков и монет в полкроны (а Англии их чеканили тогда из серебра 925 пробы). В первых же опытах с батареей наблюдалось разложение воды с образованием газов.
Знаменитый английский химик Гемфри Дэви изготовил вольтов столб из медных и цинковых пластинок, разделенных водным раствором аммиака. Первая его батарея состояла из 60 таких элементов, а через несколько лет довел их число до тысячи. С помощью этой батареи он провел знаменитые опыты по выделению новых элементов – щелочных и щелочноземельных металлов.
Еще более грандиозную батарею построил за несколько лет до Дэви русский физик-самоучка Василий Владимирович Петров. В 1802 он создал батарею, состоящую из 4200 медных и цинковых пластин. Между металлическими кружками диаметром около 4 см прокладывались картонные кружки, пропитанные раствором хлорида аммония. «Столб Петрова», в отличие от вольтова столба, располагался горизонтально в сухих узких деревянных ящичках. Вся батарея была составлена из четырех рядов, каждый длиной около 3 м, соединенных последовательно медными скобками. О трудоемкости работы с этой батареей свидетельствует такой факт: чтобы очистить только 40 пластин после их окисления помощнику Петрова требовалось не менее часа! Теоретически такая батарея может давать напряжение до 2500 вольт. С помощью этой гигантской батареи Петров провел множество опытов: он разлагал различные вещества, в том числе органические, а также оксиды металлов – ртути, свинца и олова. В 1803 Петров впервые в мире получил электрическую дугу и указал на возможность ее практического применения; так, с ее помощью ему удалось расплавить металлы, ярко освещать большие помещения.
В течение XIX в. трудами физиков и химиков была заложена теория работы гальванических элементов; основная заслуга в этом принадлежит немецкому физикохимику Вальтеру Нернсту. Конструкция элементов также была значительно усовершенствована. Главный итог работы теоретиков таков: в гальваническом элементе происходит прямое превращение химической энергии в электрическую. Для этого в элементе должна протекать окислительно-восстановительная реакция, например, растворение цинка в кислой среде: Zn + 2H+ = Zn2+ + H2. Атомы цинка (восстановители) отдают электроны: Zn – 2e ® Zn2+, а ионы водорода (окислители) их принимают: 2H+ + 2e ® H2. В гальваническом элементе процессы окисления и восстановления пространственно разделены: водород должен выделяться не на цинке, а на меди. Тогда электроны от цинка к меди будут переходить не непосредственно в растворе (в этом случае они теряются без пользы), а через внешнюю цепь, где могут совершать полезную работу. Именно так работает элемент Вольта.
Ток в элементе снимается с помощью двух электродов. В соответствии с принятой номенклатурой, на одном из них – аноде протекает процесс окисления, а на катоде идет восстановление. Поэтому цинковый электрод гальванического элемента – это анод, а медный – катод (при электролизе солей цинка он выделяется на катоде, так как при этом цинк не окисляется, а восстанавливается: Zn2+ + 2e ® Zn; аналогично при электролизе с медным анодом медь окисляется: Cu – 2e ® Cu2+, так что определение катода и анода остается в силе)
Действие гальванического элемента прекращается после полного или частичного израсходования какого-либо электрода (например, цинка). Так как протекающая в элементе химическая реакция необратима, его нельзя снова «зарядить». Электродвижущая сила элемента (ЭДС) не зависит от размеров и конструкции электродов, от количества электролита, но зависит от природы протекающей химической реакции, от состава и концентрации электролита. Если эти параметры известны, ЭДС можно рассчитать. Рассчитать можно и теоретическую емкость элемента. Так, по закону Фарадея для растворения 1 моль цинка требуется 2 моль электронов, или 96500 кулонов (ампер-секунд) электричества, или 26,8 ампер-часов.
Способность металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла характеризуется его стандартным электродным потенциалом. Ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов (при стандартных условиях концентрации всех ионов равны 1 моль/л, давление всех газов составляет 1 атм.
Чтобы определить стандартный электродный потенциал металла, измеряют ЭДС гальванического элемента, один из электродов которого – исследуемый металл, погруженный в раствор его соли (при концентрации 1 моль/л), а второй электрод – эталонный (его еще называют водородным). Он изготовлен из очень пористой губчатой платины и опущен в раствор кислоты (концентрация ионов H+ 1 моль/л); платиновый электрод непрерывно омывает газообразный водород (под давлением 1 атм), который частично растворяется в платине. Таким образом, все электродные потенциалы – не абсолютные, а относительные, измеренные для гальванической пары металл – водород (потенциал стандартного водородного электрода принимают равным нулю). Измеренные в таких условиях потенциалы различных металлов всегда будут постоянными, они занесены во все справочники и приводятся обычно для температуры 25оС). Электродные потенциалы самых активных металлов, реагирующих с водой, получены косвенным путем.
Электродные потенциалы записывают как потенциалы восстановления ионов металлов. Самый отрицательный потенциал (–3,04 В) – у реакции Li+ + e ® Li; один из самых положительных (+1,68 В) – у реакции Au+ + e ® Au. Это значит, что ЭДС гальванической пары литий-золото (если бы такая пара могла работать в водной среде) была бы равна 4,72 В; для распространенной пары медь-цинк ЭДС значительно меньше и равна 1,10 В (соответствующие потенциалы металлов равны –0,76 и +0,34 В). Для неводных электролитов можно использовать и щелочные металлы; так устроены, например, литиевые элементы (их применяют, в частности, для питания стимуляторов сердца) – они дают ЭДС до 3,5 В. Конечно, потенциалы для неводных растворов другие.
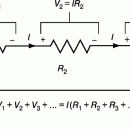
При работе гальванического элемента, когда через него и через внешнюю цепь идет ток, напряжение на электродах снижается; это снижение по закону Ома зависит от внутреннего сопротивления элемента (обычно оно составляет от 1 до 20 Ом) и от силы тока. Для некоторых элементов это снижение невелико и не превышает 0,1 В, для других может быть значительно большим. Применительно к источникам тока снижение напряжения на электродах при работе элемента называется поляризацией. Она зависит от химической природы и конструкции электродов, от состава и концентрации электролита, плотности тока, температуры. Так называемая химическая поляризация часто наблюдается при выделении на электродах водорода и кислорода. Величина такой поляризации в очень сильной степени зависит от материала электрода. Например, если в элементе Вольта заменить медный электрод на платиновый, то напряжение элемента возрастет почти на 0,5 В. Если же вместо медного электрода взять свинцовый, то напряжение, наоборот, упадет примерно на 0,6 В. Разность между экспериментальным и теоретическим потенциалом электрода для данной концентрации ионов водорода и плотности тока называется перенапряжением водорода на этом электроде. Поляризация играет роль и в процессах электролиза: если бы ее вовсе не было, разряд ионов водорода шел бы уже при очень малом напряжении на электродах, чего не наблюдается.
В элементе Вольта даже при незамкнутой внешней цепи все-таки идет окислительно-восстановительная реакция на границе цинк-кислота (катодами служат примеси в цинке). Поэтому этот источник тока на практике не применяется. Кроме того, выделяющиеся на медном электроде и прилипающие к нему пузырьки водорода сильно мешают работе элемента. На это обстоятельство в 1836 обратил внимание Джон Фредерик Даниель – британский химик и метеоролог (он изобрел также измеритель влажности – гигрометр). В его конструкции цинковый электрод погружен в раствор цинкового купороса (сульфата цинка), а медный – в раствор медного купороса (сульфата меди). В результате на медном электроде водород не выделяется, а идет реакция восстановления ионов меди: Cu2+ + 2e ® Cu. Чтобы оба электролита не смешивались, Даниель разделил их пористой перегородкой из необожженной глины. Такое устройство впервые обеспечило длительное и равномерное действие гальванического элемента, а его ЭДС (электродвижущая сила) близка к теоретической и равна 1,09 В. За это изобретение Даниель был удостоен высшей награды Королевского общества – золотой медали Копли. Независимо аналогичный элемент был разработан российским ученым Б.С.Якоби. Этот элемент при сравнительной простой конструкции обладал значительной емкостью и в течение нескольких десятилетий применялся как источник питания на телеграфе. И в настоящее время работу химических источников тока объясняют на примере элемента Даниеля.
Иначе решили проблему поляризации катода Грене, Бунзен и Гроув. Грене заменил медный электрод угольным, а к раствору серной кислоты добавил дихромат калия. Дихроматы в кислой среде – очень сильные окислители, поэтому водород на катоде просто окислялся до воды. В элементе Бунзена угольный катод был погружен в концентрированную азотную кислоту, которая находилась в пористом керамическом сосуде, а снаружи был цинковый анод в разбавленной серной кислоте. Именно элементы Бунзена послужили Ч.М.Холлу, впервые получившему алюминий методом электролиза. У Гроува вместо угольного электрода был платиновый, а цинк Гроув амальгамировал. Чтобы цинк не растворялся в кислоте в то время, когда такими элементами не пользуются, цинковый электрод делали подъемным.
Значительно усовершенствовал гальванический элемент и сделал его удобным для практического использования французский инженер Жорж Лекланше в 1867 (см. БАТАРЕЯ ЭЛЕКТРОПИТАНИЯ). В качестве деполяризатора он использовал диоксид марганца, который на катоде восстанавливается, препятствуя выделению газообразного водорода: MnO2 + 4H+ + 2e ® Mn2+ + 2H2O. Вначале электролитом служил водный раствор хлорида аммония; затем Лекланше стал использовать электролит, загущенный клейстером. Это революционным образом изменило дело: «сухие» элементы Лекланше перестали бояться случайного опрокидывания, их можно было использовать в любом положении. Изобретение Лекланше имело немедленный коммерческий успех, а сам изобретатель, забросив свою основную профессию, открыл фабрику по производству элементов.
В настоящее время элементы Лекланше – самые дешевые, и выпускаются миллиардами. Этому способствует доступность и дешевизна сырья: цинк дешевле меди, а MnO2 – самое распространенное соединение марганца в природе (минерал пиролюзит). Богатые залежи этой руды имеются в Африке, Бразилии, Мексике. Активная катодная смесь элементов Лекланше, которая окружает угольный катод, прессуется из диоксида марганца и графита с добавкой электролита. Цинковые аноды вначале делали из сплава, содержащего свинец, кадмий и довольно много (до 8%) ртути. Сейчас содержание ртути сведено к минимуму, а во многих элементах ртути нет вовсе (на них обозначено «mercury free»). Уже с первых дней производства элементов Лекланше было установлено, что разные источники диоксида марганца сильно влияют на характеристики элемента. Действительно, Известно по крайней мере пять кристаллических модификаций MnO2, различающихся по свойствам. Самые дешевые элементы используют природный пиролюзит, добытый в Гане, Габоне или Мексике. Вся его переработка сводится к простому перемалыванию и промывке. Чтобы получить более воспроизводимые результаты, используют химически или электрохимически модифицированный высококачественный MnO2, смешанный с угольным порошком, а вместо хлорида аммония применяют более дорогой хлорид цинка – такие элементы обычно помечают как «heavy-duty», т.е. повышенной мощности. Теперь понятно, почему разные элементы так сильно отличаются по цене и качеству.
В щелочных элементах (их массовое производство началось в 1950-е) электролитом служит цинкат калия K2Zn(OH)4 в концентрированном растворе КОН; при этом на катоде идет реакция MnO2 + H2O + e ® MnOOH + OH–. В щелочных элементах (на них значится «alkaline») анод состоит из мелких цинковых гранул в геле электролита, помещенных в стаканчик-сепаратор. Он касается внутренней стенки наружного стального цилиндра.
Если химический источник тока сделан качественно и не совершает работы (не включен ни в какую электрическую цепь), то напряжение на нем может не меняться буквально веками. Так, электрический звонок, хранящийся в музее физических приборов Кларендонской физической лаборатории в Оксфорде, без всякой подзарядки или смены батареи, исправно (и непрерывно) работает от батареи гальванических элементов уже свыше полутора веков!
В отличие от гальванических элементов, в аккумуляторе (название происходит от латинского слова, означающего «накоплять», «собирать») используются обратимые химические реакции. Так, при разряде самого распространенного свинцового аккумулятора (их мировое производство превышает 100 млн. в год) идет реакция PbO2 + Pb + 2H2SO4 ® 2PbSO4 + 2H2O; в никель-кадмиевом – 2NiOOH + Cd ® 2Ni(OH)2 + Cd(OH)2 (аналогичная реакция идет в никель-железном аккумуляторе); в серебряно-цинковом Ag2O + Zn ® ZnO + 2Ag; при заряде все эти реакции идут в обратном направлении. Поэтому аккумулятор можно заряжать с помощью внешнего источника тока. Аккумуляторы (например, для радио или мобильного телефона) заметно дороже гальванических элементов.
Аккумуляторы дают примерно такое же напряжение, как и гальванические элементы. Так, самый распространенный кислотный свинцовый аккумулятор дает около 2 В, щелочной никель-кадмиевый – около 1,3 вольт, а никель-железный – около 1,4 вольт. Такого напряжения вполне достаточно для работы кварцевых часов, но уже лампочка для карманного фонаря гореть от одного аккумулятора не будет. Поэтому, как и гальванические элементы, аккумуляторы для повышения напряжения соединяют в батареи. Для питания диктофона, плейера или фотоаппарата достаточно двух соединенных последовательно аккумуляторов. На автомобилях соединяют последовательно уже шесть свинцовых аккумуляторов; они способны кратковременно давать очень большой ток, необходимый для запуска двигателя. Гальванические элементы и батареи больших токов давать не могут. Аккумуляторы работают также на космических кораблях, в электромобилях и электрокарах, их используют для аварийного освещения.
В 1970 были начаты исследования нового типа аккумуляторов – никель-гидридных, а в 80-е годы появились первые рабочие образцы, в которых ток генерировался в результате реакции 2NiOOH + H2 ® 2Ni(OH)2. При заряде водород снова выделялся. Так как водород для таких аккумуляторов находится под большим давлением, блок с электродами помещают в стальной цилиндр. Эти аккумуляторы запасали на 40% больше энергии (на единицу массы), чем никель-кадмиевые. Из-за высокой стоимости (тысячи долларов каждый) эти аккумуляторы применяли прежде всего там, где особенно важна экономия веса, т.е. в космической технике. В последние годы разработаны миниатюрные металл-гидридные аккумуляторы; в них при заряде катионы водорода в электролите восстанавливаются, атомы водорода диффундируют в металл (обычно используются интерметаллические составы) и образует гидрид. При разряде процесс идет в обратном направлении. Преимущество таких аккумуляторов может оценить каждый владелец мобильного телефона.
О потенциальных возможностях аккумуляторов говорит такой факт. В Западном Берлине, опасаясь отключения электроэнергии властями ГДР (в 1961 году уже была предпринята попытка задушить город блокадой), соорудили огромную аккумуляторную батарею. Эта батарея массой 630 тонн при мощности 17 мегаватт могла в случае необходимости в течение часа, до запуска аварийных электростанций, снабжать многомиллионный город электроэнергией.
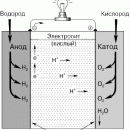
В последние десятилетия интенсивные работы ведутся по созданию и усовершенствованию топливных элементов – устройств, вырабатывающих электроэнергию за счет химической реакции между веществами, которые непрерывно подаются к электродам извне. Окислителем чаще всего служит кислород, а топливом может быть, например, водород. На базе таких элементов уже работают опытные электростанции.
Илья Леенсон
Марио Льоцци. История физики. М., Мир, 1970
Элементарный учебник физики. Под ред. Г.С.Ландсберга, т. 3, М., Наука, 1972
Ответь на вопросы викторины «Неизвестные подробности»